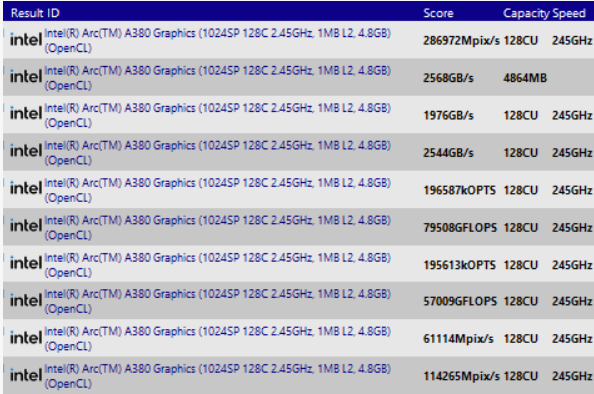
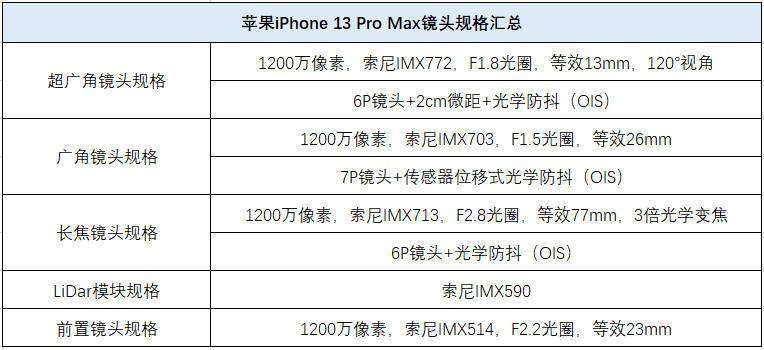
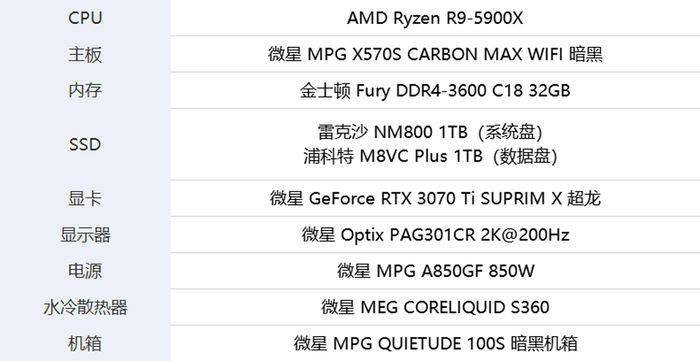
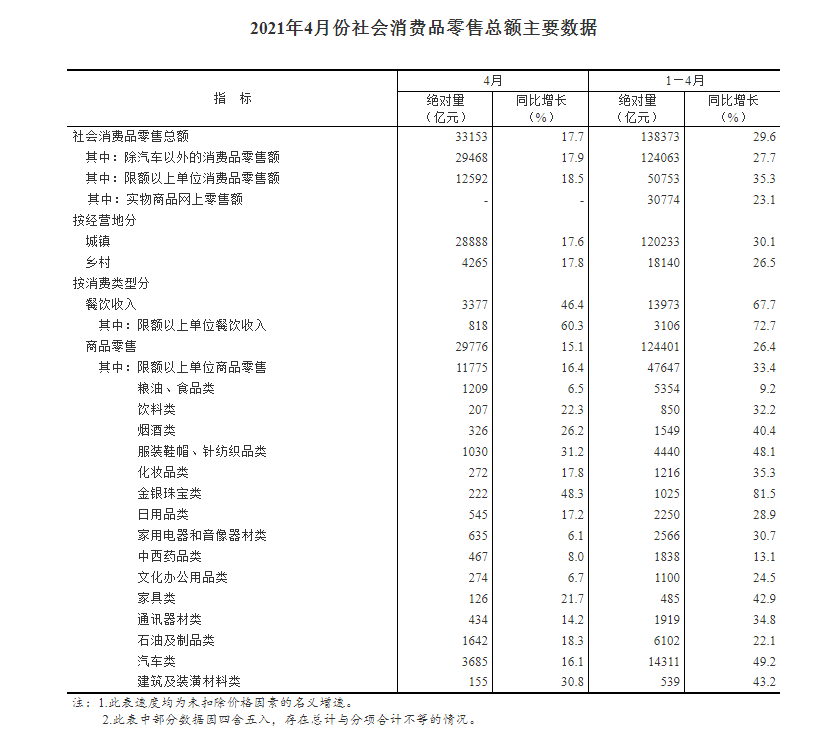
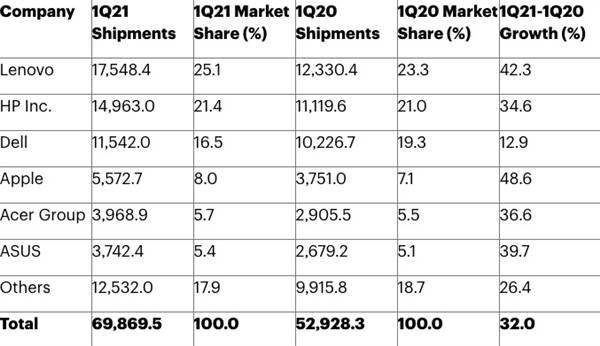
制药公司诺瓦瓦克斯(Novavax)周一表示,已向美国食品和药物管理局(Food and Drug Administration,简称FDA)提交了一份申请,寻求批准其拖延已久的蛋白质基新冠疫苗。
访问:
微软Surface精选机型特惠6.3折起 翻新机满100减100
目前还不清楚如果诺瓦瓦克斯的疫苗获得批准,它将在美国发挥什么作用。联邦政府在2020年与该公司达成的两项协议中订购了1.1亿剂这种疫苗,但美国现在有大量其他疫苗,不需要更多的供应。
诺瓦瓦克斯首席执行官斯坦·厄克(Stan Erck)在一份声明中表示,该公司正在与美国政府密切合作,“制定一项计划,其中包括剂量、生产、时间安排,以及正在进行的助推器和儿科临床试验研究,以支持他们对疫情的应对。”
诺瓦瓦克斯公司的疫苗使用的是一种更传统的方法,而不是那些开发和批准速度更快的疫苗。这可能会吸引那些对接种诸如辉瑞(Pfizer-BioNTech)和莫德那(Moderna)公司疫苗犹豫不决的人,它们使用的是较新的信使RNA技术。Novavax公司的产品使用了微小的颗粒,其中点缀着病毒蛋白,并混合了一种增强免疫的化合物,即佐剂。这种疫苗每隔三周注射两针。
诺瓦瓦克斯的疫苗于去年11月在印度尼西亚获得了首次授权,此后该疫苗又获得了包括世界卫生组织和欧盟委员会在内的其他监管机构的授权。
诺瓦瓦克斯公司的疫苗被发现可以预防由早期病毒引起的疾病。该公司表示,其疫苗可以产生针对Omicron变种的免疫反应,但这种保护作用有多强还有待观察。
在疫情的最初几个月里,诺瓦瓦克斯的疫苗是特朗普政府加快疫苗开发的“曲速行动”(Operation Warp Speed)所选的六种获得融资的疫苗之一。但马里兰州的诺瓦瓦克斯公司(Novavax)从未将一种产品推向市场,它落后于其他疫苗开发商。该公司苦于提高生产能力,并向监管机构展示其疫苗的纯度。